Propiedades de los alcoholes
|
||||||||||||||||||||||||||||||||||||||||||||
Los alcoholes son compuestos que presentan en la cadena carbonada uno o más grupos hidroxi u oxidrilo (-OH).
|

|
|||||||||||||||||||||||||||||||||||||||||||
Propiedades Físicas:
|
||||||||||||||||||||||||||||||||||||||||||||
 |
||||||||||||||||||||||||||||||||||||||||||||
Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
|
|
|||||||||||||||||||||||||||||||||||||||||||
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||
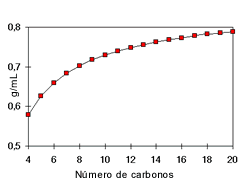
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
|
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
|
Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas.
|
|||||||||||||||||||||||||||||||||||||||||||
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
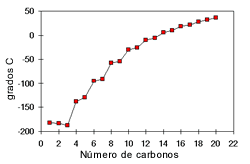
Punto de Ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
|
|||||||||||||||||||||||||||||||||||||||||||
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
|
|
|||||||||||||||||||||||||||||||||||||||||||
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos.
(Constantes Físicas de algunos alcoholes)
|
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Propiedades Químicas:
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo.
| ||||||||||||||||||||||||||||||||||||||||||||
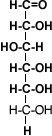
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
|
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
|
||||||||||||||||||||||||||||||||||||||||||||
Deshidratación: la deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
La deshidratación es posible ya que el alcohol acepta un protón del ácido, para formar el alcohol protonado o ión alquil hidronio.
|
|||||||||||||||||||||||||||||||||||||||||||
El alcohol protonado pierde una molécula de agua y forma un ión alquil-carbonio:
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
El ión alquil-carbonio pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece el doble enlace de la molécula a la cual está dando origen el alcohol.
|
|||||||||||||||||||||||||||||||||||||||||||
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres.
|
||||||||||||||||||||||||||||||||||||||||||||
Obtención de alcoholes: al igual que a partir de los alcoholes se pueden obtener otros compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de alquilo. Para la obtención de alcoholes por hidratación de alquenos se utiliza el ácido sulfúrico y el calor.
|
||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||
La hidroboración: (adición de borano R3B) de alqueno en presencia de peróxido de hidrógeno (H2O2) en medio alcalino da origen a un alcohol.
|
|
|||||||||||||||||||||||||||||||||||||||||||
|
La hidrólisis: de halogenuros de alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que reaccionan para formar alcoholes.
|
|||||||||||||||||||||||||||||||||||||||||||
En la industria la producción de alcoholes se realiza a través de diversas reacciones como las ya mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por la industria para la producción de alcoholes se encuentra la fermentación donde la producción de ácido butírico a partir de compuestos azucarados por acción de bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para la producción de alcoholes superiores en la industria la fermentación permite la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de aminoácidos. Es así como la industria utiliza los procesos metabólicos de ciertas bacterias para producir alcoholes
|
||||||||||||||||||||||||||||||||||||||||||||
Usos de los alcoholes
El etanol puede utilizarse como combustible para automóviles por sí mismo o también puede mezclarse con gasolina en cantidades variables para reducir el consumo de derivados del petróleo. El combustible resultante se conoce como gasohol (en algunos países, "alconafta"). Dos mezclas comunes son E10 y E85, que contienen el etanol al 10% y al 85%, respectivamente.
El etanol también se utiliza cada vez más como añadido para oxigenar la gasolina estándar, como reemplazo para el metil terc-butil éter. Este último es responsable de una considerable contaminación del suelo y del agua subterránea. También puede utilizarse como combustible en las celdas de combustible.
El etanol que proviene de los campos de cosechas (bioetanol) se perfila como un recurso energético potencialmente sostenible que puede ofrecer ventajas medioambientales y económicas a largo plazo en contraposición a los combustibles fósiles. Se obtiene fácilmente del azúcar o del almidón en cosechas de maíz y caña de azúcar, por ejemplo. Sin embargo, los actuales métodos de producción de bio-etanol utilizan una cantidad significativa de energía comparada al valor de la energía del combustible producido. Por esta razón, no es factible sustituir enteramente el consumo actual de combustibles fósiles por bio-etanol.

El metanol, butanol, y algunos tipos de aceite vegetal son tres alternativas a ethanol. metanol y butanol pueden usarse a reemplace o extienda gasolina o combustible del diesel. Los aceites vegetales de , sin embargo, se limita a reemplazar sólo combustible del diesel hasta la investigación extensa demuestra por otra 

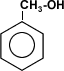
El metanol es la alternativa más importante. es un alcohol líquido el un átomo del carbono conteniendo ([CH.sub.3]OH). Like el etanol, se usa para reemplazar o se mezcle con la gasolina. El Metanol de se produce por un proceso químico que usa el metano como el feedstock primario.
El metanol también puede producirse de carbón o biomasa. En un la balanza mundial, la industria de producción de metanol es relativamente grande, y usa el embrague electromagnético para el feedstock. La Metanol producción requiere temperatura alta, presión alta, y los catalizadores especiales.
Este proceso es mucho más complejo que la producción del etanol y es generalmente barato en sólo plantas industriales muy grandes.

El butanol es un alcohol del cuatro-carbono. tiene dos posible químico las estructuras, dependiendo de la posición del hidróxilo,: El N butanol ([CH.sub.3] [CH.sub.2] [CH.sub.2][CH.sub.2]OH) y 2 butanol ([CH.sub.3] [OH.sub.1] [CH.sub.2] [CH.sub.3]) la Fermentación de azucares . produce butanol. NO etanol Diferente o metanol, el butanol puede sustituya para o se mezcle con el combustible del diesel en la condensación la ignición engines. de que se produce por la fermentación bacteriana el almidón - o azúcar-conteniendo el feedstocks y purificó por la destilación.
Las bacterias producen etanol y acetona además del el producto principal, el butanol.
La producción de butanol tiene dos desventajas: (1) la fermentación de butanol es difícil comparado con eso de etanol; y (2) la fermentación del butanol produce el combustible menos-útil por la unidad de el feedstock que la fermentación del etanol con la levadura. El Butanol de ha sido producido comercialmente bajo las condiciones de tiempo de guerra. Todavia, sin embargo, el butanol ya no se produce comercialmente para el uso como el combustible.

El Propanol vulgarmente se lo llama “Alcohol Propílico” (CH3-CH2-CH2-OH).
El Propanol ,se utiliza como un antiséptico aún más eficaz que el alcohol etílico; es usado como un disolvente importante, su uso ams común es en forma de quitaesmalte. Además se utiliza como desnaturalizante, generalmente mezclado con otros compuestos. :)

Beneficios y riesgos para la salud
Las bebidas alcohólicas se beben en todo el mundo. Para algunos sirven como un elemento común que une para socializar, mientras que para otros hacen parte de sabrosas bebidas que contengan alcohol, para llegar a estados alterados de conciencia o para emborracharse. La paradoja de disfrutar de las bebidas alcohólicas es que viene con beneficios y con riesgos no sólo para tu salud física, sino también otros ámbitos importantes de tu vida, incluyendo el trabajo y las relaciones. La clave para permanecer en el lado de cosechar las ventajas del uso del alcohol reside en el consumo seguro y moderado.
Ventaja: Salud del corazón
El sistema cardiovascular incluye el corazón, el sistema circulatorio y el neurológico, y el asesino principal de hombres y mujeres americanos es la enfermedad cardiovascular. Lasenfermedades cardiovasculares pueden afectar a las arterias y al corazón, los vasos sanguíneos que conducen a los principales órganos o al cerebro, e incluye daños a cualquiera de estos sistemas que pueden conducir a una apoplejía o un ataque al corazón. Las personas libres de complicaciones cardiovasculares pueden realmente proteger a este sistema con el consumo moderado de alcohol. De acuerdo con la Universidad de Harvard Health Publications, el uso moderado de alcohol aumenta la lipoproteína de alta densidad, o colesterol bueno, el nivel en el torrente sanguíneo, que desempeña un papel en la reducción del riesgo de coágulos en los vasos sanguíneos.
Desventaja: riesgos para la salud del corazón
El consumo moderado de alcohol en adultos sanos puede ser cardio-protector, pero el consumo excesivo de alcohol o el consumo de alcohol si tienes una enfermedad cardiaca aumenta el riesgo de complicaciones cardíacas. El consumo continuado de alcohol si tienes presión arterial alta puede conducir a la obstrucción en las arterias del cerebro, causando una interrupción repentina o grave en el suministro de sangre del cerebro, o un derrame cerebral. El consumo excesivo de alcohol también aumenta el riesgo de hipertensión arterial crónica, que afecta a la funcionalidad de tu corazón.
Ventajas: otra reducción de riesgo en la salud
La diabetes tipo 2, una forma de enfermedad metabólica crónica, debido a la producción insuficiente de la insulina, puede ser resultado de diferentes factores que contribuyen, al igual que la mala alimentación, las complicaciones pancreáticas o la obesidad. Los estudios indican que el riesgo de desarrollar diabetes se reduce con el consumo regular, moderado de alcohol, pero el beneficio exacto de alcohol en la administración de glucosa en la sangre justifica la investigación en curso. Los cálculos biliares se desarrollan en la vesícula biliar y pueden ser resultado de exceso de colesterol en la dieta. El alcohol podría reducir el riesgo de la acumulación de colesterol que conduce a cálculos biliares. En consecuencia, el consumo excesivo de alcohol también puede causar complicaciones en el manejo de la glucosa en sangre si tienes diabetes y las funciones del hígado pobres que aumentan el riesgo de cálculos biliares.
Desventajas: abuso y alcoholismo
El impacto psicológico del consumo de alcohol se presenta con una amplia gama de consecuencias, dependiendo de su patrón de consumo. El exceso de alcohol se produce cuando bebes de una forma que no es segura y daña a otras personas. El consumo excesivo de alcohol es una forma de abuso del mismo. Los desmayos o envenenamiento por alcohol resultantes de un exceso de consumo son graves efectos residuales del exceso del alcohol. El alcoholismo se desarrolla con el tiempo, ya que se requieren más bebidas para conseguir resultados embriagantes, cuando experimentas síntomas de retraimiento cuando no bebes, y cuando te involucras en comportamientos riesgosos que te afectan a ti y a los demás. El alcoholismo y el abuso a menudo resultan en pérdida de relaciones, la pérdida de empleo, los accidentes de tráfico o la violencia.
Consumo moderado de alcohol
Una bebida estándar de alcohol es una cerveza de 12 onzas, una copa de vino de 5 onzas o un vaso de 1,5 onzas de 80 grados de bebida destilada, según MayoClinic.com. El consumo moderado de alcohol para un hombre equivale a no más de dos bebidas estándar al día y para las mujeres es el equivalente de una bebida estándar al día. Si actualmente no tomas bebidas alcohólicas, no empieces, porque puedes obtener beneficios saludables para el corazón a través de otros medios dietéticos. Si tienes un problema con el alcohol, busca ayuda profesional para prevenir la salud a largo plazo y las complicaciones psicológicas.
Estructura y propiedades de los compuestos químicos orgánicos
Las propiedades físicas de un compuesto dependen principalmente del tipo de enlaces que mantienen unidos a los átomos de una molécula. Éstos puede indicar el tipo de estructura y predecir sus propiedades físicas. A continuación se darán a conocer los tipos de enlaces que influencian las propiedades de los compuestos químicos.
Enlaces iónicos: estos enlaces se forman cuando un átomo que pierde electrones, relativamente fácil (metal) , reacciona con otro que tiene una gran tendencia a ganar electrones (no metal).
El ejemplo típico de compuesto iónico son las sales. El cloruro de sodio, el yoduro de potasio, y el cloruro de magnesio, son ejemplo de estos compuestos. En la figura se puede ver la estructura del cloruro de sodio. En la forma (A) se indican las posiciones (centros) de los iones. En la forma (B) se representan los iones como esferas empacadas.
Enlace covalente: este enlace constituye un tipo de unión bastante fuerte, donde los electrones son compartidos por los átomos que forman el compuesto. Entre los compuestos que forman enlaces covalentes se encuentran el oxígeno, hidrógeno, nitrógeno, dióxido de carbono, naftaleno, agua y amoniaco, entre otros. En la molécula de H2, por ejemplo, los electrones residen principalmente en el espacio entre los núcleos, donde son atraídos de manera simultánea por ambos protones. El aumento de fuerzas de atracción en esta zona provoca la formación de la molécula de H2 a partir de dos átomos de hidrógeno separados.

La formación de un enlace entre los átomos de hidrógeno implica que la molécula de H2 es más estable por determinada cantidad de energía, que dos átomos separados (energía de enlace).

La letra griega (delta) indica una carga parcial o fraccionaria.
Enlace Covalente Polar: en este enlace el par de electrones no se encuentra distribuido equitativamente entre los átomos. Las moléculas están formadas por átomos que tienen diferente electronegatividad y que se hallan dispuestos de manera que en la molécula existen zonas con mayor densidad de electrones que otras (polo negativo y positivo respectivamente). Este es el caso, por ejemplo, de los gases fluoruro de hidrógeno (HF), cloruro de hidrógeno (HCl), bromuro de hidrógeno (HBr) y ioduro de hidrógeno (HI).
Enlace Covalente Coordinado: en este enlace uno de los dos componentes de la ecuación “dona” el par de electrones para formar el enlace. Ejemplo: el amoníaco que dona sus electrones para formar ión amonio.
Enlace metálico: este es el tipo de enlace que existe entre los átomos de un metal, y determina propiedades tales como: el carácter conductor del calor y la electricidad en estado sólido, dureza, punto de fusión, maleabilidad, etc.
El enlace metálico tiene la posibilidad de deformación sin que se produzca la rotura del cristal como ocurre en los sólidos iónicos
Fuerzas intermoleculares: Cuando los átomos se unen mediante fuerzas intramoleculares representadas por cualquiera de los enlaces ya mencionados, forman moléculas. Por ejemplo, cada molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno unidos mediante enlaces covalentes. Sin embargo, el agua es una sustancia que además de encontrarse en estado gaseoso puede ser líquida o sólida (hielo), lo cual implica la intervención de fuerzas intermoleculares que permita la unión de las moléculas de agua entre sí, ya que si no existiera ninguna fuerza de enlace entre ellas, el agua siempre se encontraría en estado gaseoso.

Fuerzas de Van der Waals: Las fuerzas intermoleculares o fuerzas de Van der Waals pueden dividirse en tres grandes grupos: las debidas a la existencia de dipolos permanentes, las de enlace de hidrógeno y las debidas a fenómenos de polarización transitoria (fuerzas de London).

Atracción entre dipolo y dipolo: Esta unión intermolecular se presenta entre moléculas unidas por un enlace covalente polar. La interacción dipolo- dipolo es la atracción que ejerce el extremo positivo de una molécula polar por el negativo de otra semejante. En el cloruro de hidrógeno, por ejemplo, el hidrógeno relativamente positivo de una molécula, es atraído por el cloro relativamente negativo de otra.
Enlace de Hidrógeno: es una unión de tipo intermolecular generada por un átomo de hidrógeno que se halla entre dos átomos fuertemente electronegativos. Sólo los átomos de F, O y N tienen la electronegatividad y condiciones necesarias para intervenir en un enlace de hidrógeno. La clave de la formación de este tipo de enlace es el carácter fuertemente polar del enlace covalente entre el hidrógeno H y otro átomo (por ejemplo O). La carga parcial positiva originada en el átomo de hidrógeno atrae a los electrones del átomo de oxígeno de una molécula vecina. Dicha atracción se ve favorecida cuando ese otro átomo es tan electronegativo que tiene una elevada carga parcial negativa.

El hidrógeno es el único átomo capaz de formar este tipo de enlace porque al ser tan pequeño permite que los otros átomos más electronegativos de las moléculas vecinas puedan aproximarse lo suficiente a él como para que la fuerza de atracción sea bastante intensa. Este tipo de enlace intermolecular es el responsable, por ejemplo, de la existencia de océanos de agua líquida en nuestro planeta. Si no existiera, el agua se encontraría en forma de vapor.

Fuerzas de London: En la mayoría de los casos son fuerzas muy débiles que suelen aumentar con el tamaño molecular. Son creadas por la formación de dipolos transitorios en moléculas no polares. Para entender como se forman estos dipolos transitorios, supongamos que una molécula monoatómica de helio se acerca bastante a otra. En ese caso, debido al movimiento de los electrones, aunque la molécula sea neutra, se pueden producir en momentos determinados zonas de la molécula con mayor densidad de electrones que otras, es decir, las moléculas pueden tener a veces polaridad eléctrica. De acuerdo con esta idea, se puede pensar en el átomo de helio no polar como un átomo en el que los electrones se encuentran en los lados opuestos del núcleo y alineados con éste (a).
En todas las demás posiciones los átomos de helio presentarán una cierta polaridad debido a que el centro de la carga negativa no coincidirá con el de la positiva (b).
Si dos átomos de helio convenientemente polarizados y orientados se acercan el uno al otro lo suficiente, la fuerza de atracción eléctrica puede ser lo bastante intensa como para que se produzcan uniones intermoleculares (c). Esto se puede conseguirse bajando mucho la temperatura con lo que el movimiento es más lento. Una molécula polarizada puede incluso polarizar a otra vecina a ella que no lo esté y así inducir un dipolo.
Una vez conocidos los tipos de enlaces químicos estudiaremos su influencia en el comportamiento de los compuestos químicos con base en sus propiedades físicas.
Punto de Fusión:
En un sólido cristalino las partículas que actúan como unidades estructurales, iones o moléculas se hallan ordenadas de algún modo muy regular y simétrico; hay un arreglo geométrico que se repite a través de todo el cristal. La Fusión es el cambio del arreglo ordenado de las partículas en el retículo cristalino a uno más desordenado que caracteriza a los líquidos. La fusión se produce cuando se alcanza una temperatura a la cual la energía térmica de las partículas es suficientemente grande como para vencer enlaces que las mantienen en sus lugares.
Punto de ebullición: Aunque en un líquido las partículas tienen un arreglo menos regular y mayor libertad de movimiento que en un cristal, cada una de ellas es atraída por muchas otras. La ebullición implica la separación de moléculas individuales, o pares de iones con carga opuesta, del seno del líquido. Esto sucede, cuando se alcanza una temperatura suficiente para que la energía térmica de las partículas supere las fuerzas de cohesión que las mantienen unidas en la fase líquida. | ||||||||||||||||||||||||||||||||||||||||
| Los compuestos polares presentan puntos de fusión y ebullición más altos que los no polares de peso molecular semejante, debido a que las fuerzas intermoleculares son más fáciles de vencer que las fuerzas interiónicas. (ver tabla) | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Solubilidad: Cuando se disuelve un sólido o un líquido, las unidades estructurales (iones o moléculas) se separan unas de otras y el espacio entre ellas pasa a ser ocupado por moléculas del solvente. Sólo el agua y otros solventes muy polares son capaces de disolver, apreciablemente compuestos iónicos al formar los enlaces ión dipolo, que en conjunto aportan suficiente energía para romper las fuerzas interiónicas en el cristal. En la solución cada ión está rodeado por muchas moléculas del solvente, por lo que se dice que está solvatado (o hidratado si el solvente es agua) | 
| |||||||||||||||||||||||||||||||||||||||
| Los compuestos no polares o débilmente polares se disuelven en solventes no polares o apenas polares, ejemplo el metano se disuelve en tetracloruro de carbono (CCl4) pero no en agua. Los compuestos orgánicos que forman puentes de hidrógeno son solubles en agua, entre ellos tenemos: los alcoholes, fenoles y ácidos carboxílicosque presentan un grupo (OH). También los aldehídos y cetonas forman puente de hidrógeno con el agua al igual que los éteres debido a la presencia del átomo de oxígeno (O=, -O-) | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Las aminas primarias y secundarias forman puente de hidrógeno entre sí y con el agua debido a la presencia del grupo amino (-NH2), las aminas terciarias por no tener hidrógeno unido a nitrógeno no forman puente de hidrógeno entre sí, pero si lo forman con el agua; por esta razón casi todos los compuestos son solubles en agua. |
| |||||||||||||||||||||||||||||||||||||||
| Los compuestos que contienen –O- u –OH serán solubles si la razón entre carbonos y grupos –O- u –OH no es mayor que 3:1, así ninguno de los fenoles será altamente soluble en agua pues ya que el miembro más pequeño contiene seis carbonos (C6H5OH). | |||||||||||||||||||||||||||||||||||||||
| Densidad: Está relacionada con la dimensión de la molécula, la polaridad y el puente de hidrógeno. Los éteres por ejemplo, poseen un átomo de oxígeno (-O-) y una polaridad que tiende a acercar más las moléculas unas a otras, esto los hace más densos que los hidrocarburos correspondientes. |
| |||||||||||||||||||||||||||||||||||||||
| Sin embargo los éteres son menos densos que sus isómeros alcoholes porque estos tienen además puente de hidrógeno entre sí. | |||||||||||||||||||||||||||||||||||||||
Viscosidad: Es una medida de la dificultad con la cual se deslizan las moléculas unas sobre otras. La viscosidad aumenta con la longitud de la cadena molecular hasta llegar al estado sólido.Para los miembros de una misma serie homóloga, las constantes físicas aumentan a medida que las moléculas alcanzan mayores dimensiones. (ver tabla) | ||||||||||||||||||||||||||||||||||||||||
La Simetría: Al igual que los tipos de enlace, la conformación estructural tiene gran influencia sobre las propiedades físicas. En una cadena recta hay mayor atracción intermolecular, la ramificación aumenta la distancia entre cadenas adyacentes disminuyendo la atracción intermolecular entre las moléculas vecinas. A medida que aumentan las ramificaciones la forma de la molécula tiende a aproximarse a la de una esfera, con lo que disminuye su superficie, lo que se traduce en un debilitamiento de las fuerzas intermoleculares que pueden ser superadas a temperaturas más bajas.(ver tabla) | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Efecto inductivo: Se presenta en el estado normal de las moléculas con enlaces covalentes simples y permite que el par electrónico se desplace ligeramente cuando en la molécula existe un átomo que ejerza sobre el par electrónico una atracción mayor o menor que el resto de los átomos. El efecto inductivo puede ejercerlo un sustituyente, el cual va a polarizar de manera permanente un enlace. Esta acción se transmite a través de la cadena carbonada. |
| |||||||||||||||||||||||||||||||||||||||
| El efecto inductivo se presenta cuando se unen a un átomo de carbono, átomos o grupos atómicos aceptores de electrones (agentes electrofílicos); la excepción más importante la constituyen los grupos alquilo (-R) que son dadores de electrones (agentes neutrofílicos). Si un átomo o grupo de átomos es más electronegativo que el átomo de hidrógeno, se dice que posee un efecto inductivo negativo (-I), mientras que si es menos electronegativo que el átomo de hidrógeno, se dice que tiene efecto inductivo positivo (+I). Este efecto es el responsable del aumento o disminución de la acidez o alcalinidad (basicidad) de algunos compuestos. | ||||||||||||||||||||||||||||||||||||||||
La constante de equilibrio (ionización o acidez) para la reacción anterior, esta dada por la siguiente expresión:
 Mientras mayor es la magnitud de Ka, indica mayor fuerza del ácido. | Acidez: La propiedad química característica de los ácidos carboxílicos, es la acidez. Según Bronsted – Lowry, son ácidos porque cada grupo carboxilo tiene la capacidad de donar un protón en un intercambio ácido-base, debido al grupo OH presente. En una solución acuosa de un ácido carboxílico cualquiera, el agua actúa como aceptor de protones, es decir como una base, estableciéndose un equilibrio entre el ácido orgánico, agua, ión carboxilato y el ión hidronio. | |||||||||||||||||||||||||||||||||||||||
En aquellos compuestos que presentan sustituyentes, como en el ejemplo de la tabla donde el sustituyente es el cloro (Cl), este da lugar a que haya un desplazamiento de la densidad electrónica hacia sus vecinos, con la consiguiente disminución de densidad electrónica en el grupo carboxilo -COOH. Esta es la causa de que el átomo de hidrógeno del grupo –COOH quede más suelto y, por esta razón, la fuerza de atracción que ejerce el disolvente polar (agua) sobre este átomo de hidrógeno origina una mayor disociación. (ver tabla)
| ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Basicidad: El efecto inductivo también influye en la alcalinidad. Según Bronsted –Lowry, una base es un aceptor de protones. En una solución acuosa de amoniaco, el agua actúa como un dador de protones (ácido), los protones son aceptados por el amoniaco que actúa como una base, estableciéndose un equilibrio entre amoniaco, agua ión amonio e ión oxhidrilo. |
La
constante de basicidad se calcula aplicando la siguiente fórmula:
| |||||||||||||||||||||||||||||||||||||||
| Según la definición de Lewis, una base es una sustancia donante de pares electrónicos y un ácido un aceptor de pares electrónicos. El amoniaco, las aminas, el agua y el ión oxhidrilo son bases, pues tienen pares electrónicos disponibles que pueden compartir, mientras que el protón y el ión hidronio son ácidos, por su deficiencia en electrones. | ||||||||||||||||||||||||||||||||||||||||
Propiedades de los Eteres
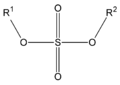
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra
"éster" proviene del alemán Essig-Äther (éter de vinagre), como se
llamaba antiguamente al acetato de etilo.
En los ésteres más comunes el ácido en
cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres
también se pueden formar con ácidos inorgánicos, como el ácido carbónico
(origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado
"éster dimetílico del ácido sulfúrico".
Éster
(éster de ácido
carboxílico)
|
Éster carbónico
(éster de ácido
carbónico)
|
Éster fosfórico
(triéster de ácido
fosfórico)
|
Éster sulfúrico
(diéster de ácido
sulfúrico)
|
 |
ZZ
 |
 |
Un ensayo recomendable para detectar
ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya
que son muy coloreados:
Ensayo del ácido hidroxámico: la
primera etapa de la reacción es la conversión del éster en un ácido hidroxámico
(catalizado por base). En el siguiente paso éste reacciona con cloruro férrico
produciendo un hidroxamato de intenso color rojo-violeta.
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada
radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO
del ácido graso. El H sobrante del grupo carboxilo, se
combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico
o inorgánico.
Los ésteres más comúnmente encontrados
en la naturaleza son las grasas, que son ésteres de glicerinay ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso
se denomina esterificación:
Un éster cíclico es una lactona.

Etanoato de metilo.
La nomenclatura de los ésteres deriva
del ácido carboxílico y el alcohol de los que procede. Así, en el etanoato
(acetato) de metilo encontramos dos partes en su nombre:
·
La primera parte del nombre, etanoato (acetato), proviene del ácido etanoico (acético)
·
La otra mitad, de metilo, proviene del
alcohol metílico (metanol).

Etanoato de etilo.
En el dibujo de la derecha se observa
la parte que procede del ácido (en rojo; etanoato) y la parte que
procede del alcohol (en azul, de etilo).
Luego el nombre general de un éster de
ácido carboxílico será "alcanoato de alquilo" donde:
alcan-= raíz de la cadena carbonada principal (si es un alcano), que se
nombra a partir del número de átomos de carbono. Ej.:Propan- significa cadena de 3 átomos de carbono unidos por enlaces sencillos.
oato = sufijo que indica
que es derivado de un ácido carboxílico. Ej: propanoato: CH3-CH2-CO-
significa "derivado del ácido propanoico".
de alquilo: Indica el alcohol de procedencia.
Grupo general:...
Por ejemplo: -O-CH2-CH3 es "de etilo" En conjunto CH3-CH2-CO-O-CH2-CH3 se nombra propanoato de etilo.
Propiedades físicas
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden
participar como donadores en este tipo de enlaces, a diferencia de los
alcoholes de los que derivan. Esta capacidad de participar en los enlaces de
hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno
los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta
falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el
que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más
volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma
característico, lo que hace que se utilicen ampliamente como sabores y
fragancias artificiales. Por ejemplo:
acefato de 2 etil hexilo: olor a dulzon suave
butanoato de metilo: olor a piña
salicilato de metilo (aceite de siempreverde o menta): olor
de las pomadas Germolene™ y Ralgex™ (Reino unido)
octanoato de heptilo: olor a frambuesa
etanoato de isopentilo: olor a plátano
pentanoato de pentilo: olor a manzana
· butanoato de pentilo: olor a pera o a albaricoque
etanoato de octilo olor a naranja
Los ésteres también participan en la hidrolisis esterárica: la ruptura de un éster por agua. Los ésteres también pueden ser
descompuestos por acidos o bases fuertes. Como resultado, se descomponen en un alcohol y un acido carboxilico, o una sal de un ácido carboxílico:
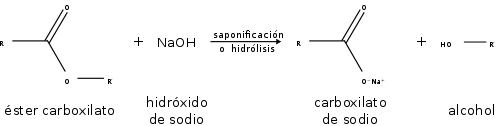
Reacción de saponificación o hidrolisis.
Propiedades químicas
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el
oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando
así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su analogía con la formación de jabones,
es la reacción inversa a la esterificación.
Los ésteres se hidrogenan más
fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con
una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro de litio y
aluminio reduce ésteres de ácidos carboxílicos para dar 2 equivalentes de
alcohol.2 La reacción es de amplio espectro y se ha utilizado para reducir
diversos ésteres. Las lactonas producen dioles. Existen diversos agentes
reductores alternativos al hidruro de litio y aluminio como el DIBALH, el
trietil-borohidruro de litio o BH3–SiMe3 reflujado con thf 3.
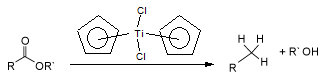
El dicloruro de titanoceno reduce los ésteres de ácidos carboxílicos hasta el alcano (RCH3)y
el alcohol R-OH.4 El mecanismo probablemente se debe a la formación de un alqueno
intermediario.
El hidrógeno α de muchos ésteres puede
ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión generado puede unirse a diversos
sustratos en diversas reacciones de condensación, tales como la condensación de Claisen , la condensacion de Dieeckmann y la síntesis malonica. Muchos métodos de síntesis de anillos heterocíclicos
aprovechan estas propiedades químicas de los ésteres, tales como la sintesis de pirroles de hantzsch y la sintesis de Feist-Benary.
Existen reacciones de condensación en las
que se utiliza un reductor que aporte electrones para formar el enlace C-C
entre grupos acilo, como el caso de la condensacion aciloinica. Los ésteres pueden dar
alcoholes con dos sustituyentes idénticos por adición de reactivos de Grignard.
Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
USOS DE LOS ETERES
- Medio para extractar para concentrar ácido acético y otros ácidos.
- Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
- Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores Diésel.
- Fuertes pegamentos
- Antinflamatorio abdominal para después del parto, exclusivamente uso externo.
Beneficios y riesgos de los Eteres
Los éteres de polibromodifenilos (PBDEs) son sustancias químicas que retardan el fuego y que se agregan a productos de plástico y de espumas para hacer más difícil que se incendien. Hay diferentes tipos de PBDEs; algunos solamente tienen unos pocos átomos de bromo, mientras que otros tienen hasta diez átomos de bromo unidos a la molécula central.
Los PBDEs existen en forma de mezclas de compuestos químicos similares. Debido a que sólo se mezclan con los plásticos y espumas en vez de unirse a ellos, pueden escapar de los productos que los contienen y entrar al medio ambiente.
¿Qué les sucede a los PBDEs cuando entran al medio ambiente?
•Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo.
•En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua.
•La luz solar puede degradar algunos PBDEs.
•Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos.
•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones.
Regrese al comienzo de la página.
¿Cómo puede ocurrir la exposición a los PBDEs?
•Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs.
•Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs.
•Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal.
•También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs.
Regrese al comienzo de la página.
¿Cómo pueden afectar mi salud los PBDEs?
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.
Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
¿Qué posibilidades hay de que los PBDEs produzcan cáncer?
No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales.
¿Cómo pueden los PBDEs afectar a los niños?
Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
¿Cómo pueden las familias reducir el riesgo de exposición a los PBDEs?
•A los niños que viven cerca de sitios de desechos peligrosos se les debe aconsejar no jugar en la tierra cerca de estos sitios. También se les debe enseñar a no comer tierra y a lavarse las manos con frecuencia.
•Las personas que están expuestas a los PBDEs en el trabajo deben ducharse y cambiar de ropa cada día antes de volver al hogar. La ropa de trabajo debe guardarse y lavarse en forma separada de la ropa del resto de la familia.
Nombre y estructura de los componentes mas representativos de los eteres
1 Estructura y nomenclatura de los éteres
Los éteres son compuestos de fórmula general R-O-R, Ar-O-R o Ar-O-Ar.Para designar los éteres, por lo general se indican los dos grupos unidos al oxígeno, seguidos de la palabra éter:
 |
Si un grupo no tiene un nombre simple, puede nombrarse el compuesto como un alcoxi derivado:
 |
El más simple de los éteres aril alquílicos, el metil fenil éter, tiene el nombre especial de anisol.
 |
Si los dos grupos son idénticos, se dice que el éter es simétrico (por ejemplo, dietil éter, diisopropil éter); si son diferentes, es asimétrico (por ejemplo, t-butil metil éter).
Propiedades fisicas y quimicas de los Esteres
PROPIEDADES FISICAS:
Al tratarse de compuestos moleculares (líquidos volátiles o sólidos) sus propiedades físicas más representativas son:
Aislantes eléctricos en fusión y en disolución.
Bajo temperatura de fusión y ebullición que crece con la masa molar. Las propiedades físicas y químicas de los ésteres de bajo peso molecular corresponden, en general, a una combinación de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte de hidrocarburo de la molécula tiene un efecto preponderante sobre las funciones oxigenadas, razón por la cual los ésteres superiores son ceras sólidas, blandas e insolubles en agua.
Según la longitud de la cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles en disolventes orgánicos (hexano, éter, benceno, acetona…)
A causa del número extraordinariamente elevado de ácidos y alcoholes que pueden utilitzarse en la reacción de esterificación, se han preparado y estudiado miles de ésteres, desde el más sencillo (HCOOCH3, formiato de metilo), hasta los compuestos de peso molecular más elevado que contienen 30 o más átomos de carbono en ambas partes de la molécula.
PROPIEDADES QUIMICAS:
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados.
La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.

Los Esteres son compuestos que se forman por la unión de ácidos con alcoholes, generando agua como subproducto.
Como se ve en el ejemplo, el hidroxilo del ácido se combina con el hidrógeno del radical hidroxilo del alcohol.
Nomenclatura: Se nombran como si fuera una sal, con la terminación “ato” luego del nombre del ácido seguido por el nombre del radical alcohólico con el que reacciona dicho ácido.
Los ésteres se pueden clasificar en dos tipos:
Ésteres inorgánicos: Son los que derivan de un alcohol y de un ácido inorgánico. Por ejemplo:
Ésteres orgánicos: Son los que tienen un alcohol y un ácido orgánico. Como ejemplo basta ver el etanoato de propilo expuesto arriba.
Otro criterio o forma de clasificarlos es según el tipo de ácido orgánico que se uso en su formación. Es decir, si se trata de un ácido alifático o aromático. Aromáticos son los derivados de los anillos bencénicos como se ha explicado anteriormente. Para los alifáticos hacemos alusión nuevamente al etanoato de propilo anteriormente expuesto.
Al proceso de formación de un éster a partir de un ácido y un alcohol se lo denomina esterificación. Pero al proceso inverso, o sea, a la hidrólisis del éster para regenerar nuevamente el ácido y el alcohol se lo nombra saponificación. Este término como veremos es también usado para explicar la obtención de jabones a partir de las grasas.
Obtención de Ésteres:
Veremos algunos de los métodos más usados.
Los ésteres se preparan combinando un ácido orgánico con un alcohol. Se utiliza ácido sulfúrico como agente deshidratante. Esto sirve para ir eliminando el agua que se forma y de esta manera hacer que la reacción tienda su equilibrio hacia la derecha, es decir, hacia la formación del éster.
Combinando anhídridos con alcoholes.
Usos de los Esteres
Medio para extractar para concentrar ácido acético y otros ácidos.
Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
Combustible inicial de motores Diésel.
Fuertes pegamentos.
Antinflamatorio abdominal para después del parto, exclusivamente uso externo.
Los ésteres son empleados en muchos y variados campos del comercio y de la industria, como los siguientes:
Disolventes:
Los ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico.
Plastificantes:
El acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa.
Aromas artificiales:
Muchos de los ésteres de bajo peso molecular tienen olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la fabricación de aromas y perfumes sintéticos.
Aditivos Alimentarios:
Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
Productos Farmacéuticos:
Productos de uso tan frecuente como los analgésicos se fabrican con ésteres.
Polímeros Diversos:
Los ésteres de los ácidos no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo (lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster, conocidas como gliptales, resultan de la poliesterificación de la glicerina con anhídrido ftálico; el proceso puede controlarse de manera que se produzca una resina fusible o infusible. Cuando la poliesterificación se realiza en presencia de un ácido no saturado de cadena larga del tipo de los aceites secantes, la polimerización de éste por oxidación se superpone a la poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a la intemperie, que son muy adecuados por el acabado de los automóviles. La poliesterificación del etilenglicol con el ácido tereftálico produce fibra de poliéster. Si se da forma de láminas a este material, constituye una excelente película fotográfica.
Repelentes de insectos:
Todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
Beneficis y riesgos de los Esteres para la salud
Qué son los PBDEs?
Los éteres de polibromodifenilos (PBDEs) son sustancias químicas que retardan el fuego y que se agregan a productos de plástico y de espumas para hacer más difícil que se incendien. Hay diferentes tipos de PBDEs; algunos solamente tienen unos pocos átomos de bromo, mientras que otros tienen hasta diez átomos de bromo unidos a la molécula central.
Los PBDEs existen en forma de mezclas de compuestos químicos similares. Debido a que sólo se mezclan con los plásticos y espumas en vez de unirse a ellos, pueden escapar de los productos que los contienen y entrar al medio ambiente.
¿Qué les sucede a los PBDEs cuando entran al medio ambiente?
•Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo.
•En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua.
•La luz solar puede degradar algunos PBDEs.
•Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos.
•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones.
¿Cómo puede ocurrir la exposición a los PBDEs?
•Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs.
•Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs.
•Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal.
•También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs.
.
¿Cómo pueden afectar mi salud los PBDEs?
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.
Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
¿Qué posibilidades hay de que los PBDEs produzcan cáncer?
No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales.
¿Cómo pueden los PBDEs afectar a los niños?
Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.
La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
¿Cómo pueden las familias reducir el riesgo de exposición a los PBDEs?
•A los niños que viven cerca de sitios de desechos peligrosos se les debe aconsejar no jugar en la tierra cerca de estos sitios. También se les debe enseñar a no comer tierra y a lavarse las manos con frecuencia.
•Las personas que están expuestas a los PBDEs en el trabajo deben ducharse y cambiar de ropa cada día antes de volver al hogar. La ropa de trabajo debe guardarse y lavarse en forma separada de la ropa del resto de la familia.
Beneficios:
Omega 3 ácido etil ésteres es el nombre dado a las grasas poliinsaturadas que son buenas para la salud. Estas grasas están obligadas a reducir los niveles de triglicéridos en el cuerpo, lo que controla los niveles de colesterol malo y prevención de enfermedades del corazón y paro cardíaco súbito.
Hay numerosos otros beneficios del consumo de ésteres de omega 3 ácido etílico en forma de cápsulas. Estas cápsulas son fabricadas mediante el uso de aceite de pescado, que es una de las fuentes más ricas y más saludables, particularmente DHA y EPA.
Los beneficios más notables del consumo de estos se observan en el contexto de la prevención de ciertas enfermedades como el cáncer y la enfermedad de Alzheimer. Además, también son buenos para la promoción de la salud general y salud mental particular. Ésteres de Omega 3 prevenir la depresión y la ansiedad y otros trastornos mentales relacionadas con la salud.
Los médicos han reconocido los beneficios de salud asociados con el consumo de cápsulas de aceite de pescado. Recomiendan estos suplementos a personas de todas las edades, especialmente las mujeres embarazadas, niños y ancianos.
Cápsulas son buenos para reducir la inflamación en todo el cuerpo. Dichas medidas pueden adoptarse en condiciones inflamatorias como artritis, cistitis y prostatitis. Normalmente de 3 a 4 porciones de un suplemento nutricional de omega 3 son recomendadas por los médicos. Sin embargo, si usted es deficiente, puede incrementar esta dosis.
Suplementos de omega líquido también pueden añadirse a la dieta diaria para recibir una cantidad adecuada de DHA y EPA. 1 cucharada de aceite de pescado líquido es suficiente después de cada comida. Estos suplementos son excelentes para los niños y los ancianos ya que son muy fáciles de consumir y digerir.
Algunas fuentes de alimentos que contienen ésteres de omega 3 ácido etílico son aceite de linaza, aceite de cáñamo, aceite de maíz, soya, frijoles, queso de soja, nueces y camarones. Huevos Omega 3 enriquecido también están disponibles ahora que proporcionan buenas cantidades de DHA y EPA. Usted debe también consumir pescado al menos dos veces a la semana para obtener su parte de los ácidos grasos saludables.
Si usted está buscando en línea los suplementos, es aconsejable para encontrar los hechos con alto grado o aceite de calidad farmacéutica. Este aceite es refinado y purificada a través de un proceso conocido como destilación molecular y es apto para el consumo.
Suplementos de Omega-3 no causan efectos secundarios, pero si tiene infecciones o alergias es aconsejable acudir al médico inmediatamente.
NOMBRE Y ESTRUCTURA DE LOS CONPUESTOS MAS REPRESENTATIVOS
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
| Éster
(éster de ácido carboxílico)
| Éster carbónico
(éster de ácido carbónico)
| Éster fosfórico
(triéster de ácido fosfórico)
| Éster sulfúrico
(diéster de ácido sulfúrico)
|
|---|---|---|---|
 |  |  |  |
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta.
En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
En la formación de ésteres, cada radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico.
Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación:
Un éster cíclico es una lactona.
http://es.wikipedia.org/wiki/%C3%89ster:BIBLIOGRAFIA
http://organica1.org/qo1/ok/eteres/eter1.htm:bibliografia
http://www.galeon.com/cheko/aplica.html:bibliografia
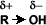
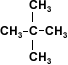

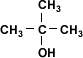
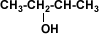
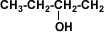
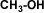
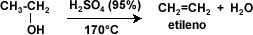
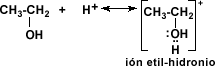
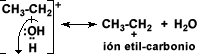
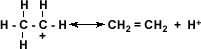
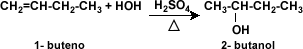
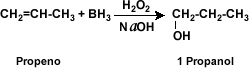
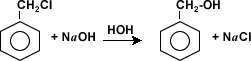


















No hay comentarios:
Publicar un comentario